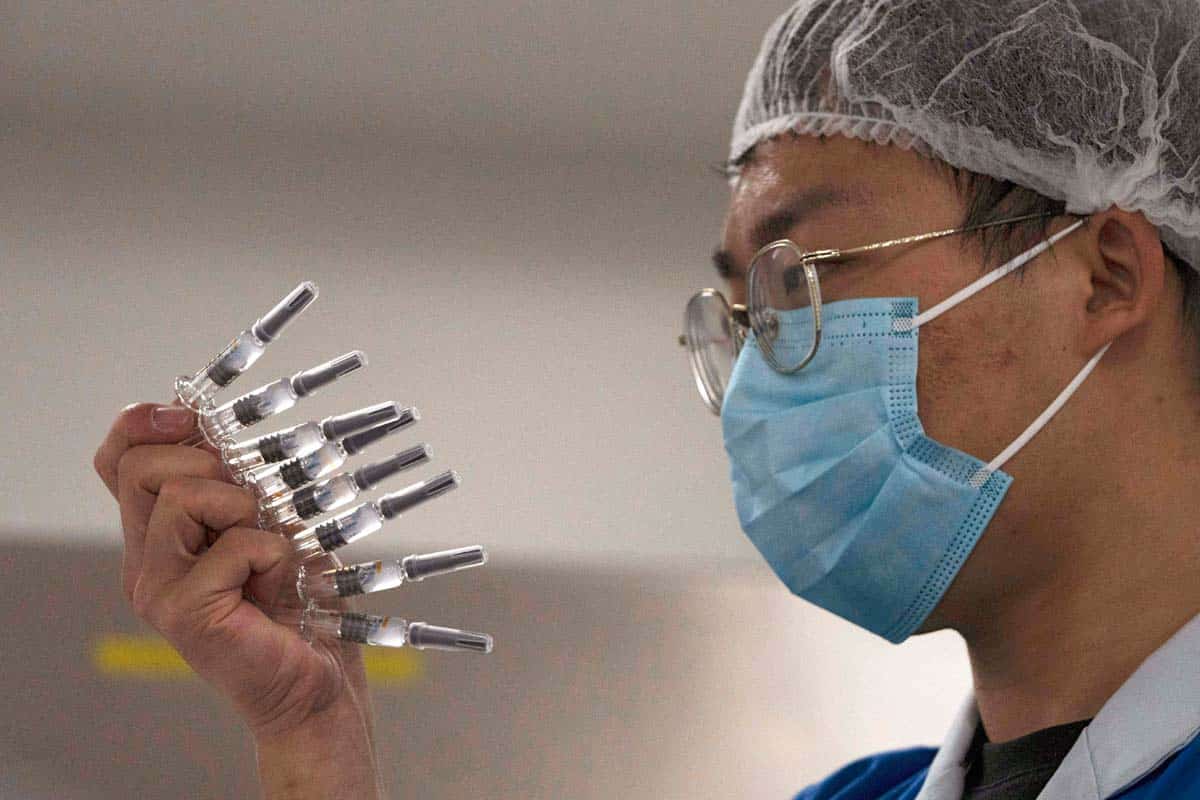
C’è chi lotta per salvare vite umane e chi per la supremazia geopolitica mondiale. La comunità medico-scientifica internazionale da un lato, i governi di Stati Uniti, Russia, Cina e dei Paesi Ue dall’altro. Realtà che spesso sono in antitesi tra loro ma che oggi “desiderano” tutte la stessa cosa e nel più breve tempo possibile: un vaccino in grado di prevenire l’infezione da coronavirus Sars-Cov-2. Come è noto, la corsa vera e propria alla produzione è iniziata a marzo nel pieno del primo picco pandemico. Ora per almeno quattro dei 46 candidati vaccini al momento testati sull’uomo (più altri 91 in fase preliminare di test sugli animali) siamo a un primo vero punto di svolta dal quale dipende la possibilità che durante l’estate 2021 possa prendere il via una vaccinazione di massa della popolazione mondiale (ma non è ancora possibile calcolare quanto tempo occorrerà prima che sia stato distribuito ovunque, di certo si arriverà almeno al 2022).
L’Agenzia europea per i medicinali (Ema), infatti, dopo aver avviato l’iter di autorizzazione per il vaccino sviluppato dalla tedesca BioNTech in collaborazione con Pfizer, per quello sviluppato dalla britannica AstraZeneca in collaborazione con l’università di Oxford e per quello statunitense prodotto da Moderna, sta per ricevere anche la richiesta della farmaceutica cinese CanSino-Bio. Che dunque esce dai confini nazionali e si sottopone alla revisione di soggetti deputati non cinesi.
Per capirsi, di norma le autorità di regolamentazione di ogni Paese esaminano i risultati delle sperimentazioni e decidono se approvare o meno il vaccino. Durante una pandemia, un vaccino può ricevere l’autorizzazione all’uso di emergenza prima di ottenere l’approvazione formale. Una volta che è stato autorizzato, i ricercatori continuano a monitorare le persone che lo ricevono per assicurarsi che sia sicuro ed efficace. Il CanSino-Bio, uno dei quattro vaccini già autorizzati da Pechino (ma non ancora alla commercializzazione), è stato sviluppato in collaborazione con l’Istituto di biologia presso l’Accademia delle scienze mediche militari. E già questo, data anche l’ovvia segretezza, ha fatto molto discutere e messo in dubbio la validità dell’antidoto. Per di più, la Cina (come la Russia del resto) ha approvato i suoi vaccini senza attendere i risultati delle sperimentazioni di fase 3. Un processo affrettato che come è facilmente intuibile può presentare seri rischi, ma ora almeno per uno dei candidati vaccino cinesi arriverà la verifica dell’Ema. Va detto tuttavia che l’accelerazione dei test non è stata una prerogativa solo di Pechino e Mosca.
Anche per altri candidati vaccino anti-Covid l’iter di sperimentazione/approvazione che di norma richiede 4-5 anni è durato pochi mesi. In particolare si sono assottigliati gli step intermedi tra Fase 2 (test su qualche centinaio di “cavie” umane) a Fase 3 (test su qualche migliaio di “cavie” umane), e la Fase 1 (su un numero ristretto di persone) in diversi casi è stata saltata a pie’ pari. Tanto è vero che CanSino-Bio è arrivato a Bruxelles dopo Pfizer, AstraZeneca e Moderna e lo ha fatto seguendo questo iter: a maggio ha pubblicato i risultati dei test sulla sicurezza di Fase 1, a luglio si è conclusa la Fase 2 di sperimentazione sull’uomo che ha coinvolto i militari dell’esercito cinese (ancora non è chiaro se la vaccinazione sia stata facoltativa o obbligatoria) e a partire da agosto è passata ai test di Fase 3 su cavie umane anche in altri Paesi, tra cui Arabia Saudita, Pakistan e Russia. A parziale rassicurazione sull’efficacia del CanSino-Bio è arrivato nei giorni scorsi un articolo pubblicato sulla rivista scientifica The Lancet nel quale i ricercatori cinesi descrivono i risultati dei test di Fase 1 e 2 che hanno coinvolto oltre 600 partecipanti volontari sani tra i 18 e gli 80 anni di età.
Secondo gli autori l’antidoto ha sviluppato una risposta anticorpale in tutti i partecipanti entro il 42esimo giorno. Come CanBio, anche Pfizer si muove ad “ampio raggio”. Per esempio sappiamo da fonti interne che da martedì scorso dosi del vaccino da testare su volontari ricoverati con sintomi sono arrivate in vari ospedali svedesi, incluso il Karolinska hospital di Stoccolma. Mentre, come è noto, al di là dell’Atlantico il vaccino Pfizer è “entrato” nella corsa alle presidenziali. Con Trump che ne ha annunciato l’arrivo prima del voto per poi essere seccamente smentito da Ceo di Pfizer, Albert Bourla. Peraltro è praticamente certo che l’approvazione da parte della Food and drug administration (l’equivalente Usa dell’Ema europea) arriverà invece dopo il 3 novembre e che le prime dosi saranno disponibili a novembre inoltrato. E questo termine temporale coincide con quanto annunciato il 6 ottobre scorso dal direttore generale dell’Oms, Tedros Adhanom Ghebreyesus, che però non aveva fatto il nome del vaccino che per primo avrebbe tagliato l’ambito traguardo dell’autorizzazione (v. Left del 16 ottobre). A proposito della Fda c’è da dire che negli Usa il vaccino di CanSino-Bio non è nemmeno in fase preliminare di approvazione. Non è un caso che, se uno dei cavalli di battaglia della campagna elettorale di Trump sia la propaganda anti-Pechino, le tensioni politiche e commerciali tra Usa e Cina trovino sfogo anche in ambito medico-scientifico. La guerra non convenzionale tra i due giganti si gioca dunque anche sul campo “nobile” della ricerca. Ma questa corsa a chi arriva per primo all’antidoto contro il Covid-19 coincide – non certo per una questione di umanità – con l’interesse per la salute di milioni di persone che a partire dalla prossima estate potrebbero evitare il contagio del virus pandemico grazie a uno di questi vaccini. Non importa quale.
*-*
Per approfondire, leggi anche: Il biotecnologo Valerio Azzimato: Il vaccino è essenziale ma nei primi mesi non sarà la panacea
Leggilo subito online o con la nostra App
SCARICA LA COPIA DIGITALE